N°7
Écologie chimique du Cannabis
David W. Pate
International Hemp Association, Postbus 75007,
1070 AA Amsterdam, Pays-Bas
Pate, D.W., 1994. L'écologie chimique du Cannabis. Journal de l'Association internationale du chanvre 2: 29, 32-37.
La production de cannabinoïdes et des terpènes(1) associés dans le cannabis est soumise aux influences de l'environnement ainsi qu’aux facteurs héréditaires. Leur biosynthèse se produit dans des glandes spécialisées qui peuplent la surface de toutes les structures aériennes de la plante. Ces composés servent apparemment comme des agents de défense dans différents rôles : anti-dessèchement, antimicrobien, anti-appétance et pigmentation par UV-B. En outre, les UV-B ambiants des tropiques, les plus intenses, en combinaison avec la labilité (2) des cannabidiol face aux UV-B, ont pu influer sur l'évolution d'un itinéraire biogénétique alternatif du cannabigerol au tétrahydrocannabinol dans certaines variétés.
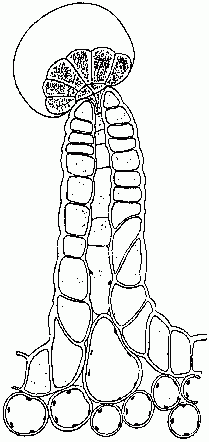
Trichome glandulaire pétiolé producteur de résine (Briosi et Tognini 1894).
Introduction
Le Cannabis a pu être la première plante cultivée. Les archives historiques indiquent l'utilisation de cette plante pour le papier, le textile, l'alimentation et la médecine à travers l'histoire humaine (Abel, 1980). C'est une plante dioïque annuelle à feuilles palmées particulières, généralement composées d'un nombre impair de folioles. Sa meilleure croissance se produit sur des sols récemment retournés de teneur en azote élevée, il est donc commun comme mauvaise herbe persistante à la lisière des champs cultivés. La hauteur à l'âge adulte varie de 1 à 5 mètres, selon les impératifs environnementaux et héréditaires. Généralement, la plante mâle est un peu plus grande et plus abondamment fleurie. Ses fleurs ont cinq sépales jaunâtres et cinq anthères qui pendent à maturité, dispersant le pollen dans le vent. La plante femelle présente un aspect plus robuste en raison de ses branches plus courtes, la croissance dense de ses feuilles et des bractées associées aux fleurs. Sa fleur ne dispose que d’un mince périanthe adhérent, mais est également protégée par un bractéole en forme de coupe (ie, de bractées périphériques) maintenu par une foliole monophylle. Un akène (3) unique est produit par la fleur et ensuite relâché ou dispersé par les oiseaux. Le cycle de vie du mâle est complet après sa floraison, mais la femelle survit jusqu'à la maturité intégrale des semences.
Le cannabis semble être une usine virtuelle pour la production de composés métaboliques secondaires. Une variété d'alcanes a été identifiée (Adams, Jr. et Jones, 1973, De Zeeuw et al. 1973b, Mobarak et al. 1974a et 1974b), ainsi que des composés azotés (ElSohly et Turner 1976, Hanus 1975b), des flavonoïdes (Gellert et al. 1974, Paris et al. 1975b, Paris et Paris 1973) et d'autres composés divers (1976a et 1976b Hanus). Les terpènes apparaissent en abondance (Hanus, 1975a, Hendricks et al. 1975) et contribuent à l'odeur caractéristique de la plante (Hood et al. 1973) et à certaines de ses utilisations brutes, comme le haschisch. Les composés actifs de ces drogues sont apparemment propres à ce genre et sont appelées cannabinoïdes. Les cannabinoïdes ont été d'abord considérés comme des composés phénoliques, mais des études ultérieures ( Fetterman et al. 1971a, Masoud et Doorenbos 1973, les petites et Beckstead 1973, Turner et al. 1973b) ont démontré qu’ils existaient principalement sous la forme d'acides carboxyliques qui se décarboxylent facilement avec le temps (Masoud et Doorenbos 1973, Turner et al. 1973b), par chauffage (De Zeeuw et al. 1972a, Kimura et Okamoto 1970) ou dans des conditions alcalines (Grlic et Andrec 1961, Masoud et Doorenboos 1973). Il y a plus de 60 de ces composés présents dans la plante (Turner et al. 1980).
Beaucoup de choses ont été publiées concernant l'influence de l'hérédité sur la production de cannabinoïdes (par exemple, Fetterman et al. 1971b, Small et Beckstead 1973) mais les facteurs écologiques ont longtemps été suspectés d’avoir une influence importante par le stress qu’ils imposent à la plante de cannabis (Bouquet 1950). L’augmentation résultante de la biosynthèse des cannabinoïdes et des terpènes contenant la résine, dans la plupart des cas, semble être un avantage pour l'organisme en l'adaptant à une variété de situations qui menacent sa survie. Cette étude passe en revue ces défis biotiques et abiotiques et spécule sur l'utilité de la résine de cannabis pour la plante.
Distribution anatomique et biogenèse des cannabinoïdes
Les sites majeurs de la production de cannabinoïdes semblent être les glandes épidermiques (Fairbairn 1972, Hammond et Mahlberg 1973, Lanyon et al. 1981, Malingre et al. 1975) qui montrent une variation marquée de la taille, de la forme et de la densité, en fonction de la partie anatomique examinée. S'il n'existe pas de rapports publiés concernant des glandes présentes sur la surface des racines, la plupart des parties aériennes en possèdent, ainsi que les trichomes non-glandulaires (De Pasquale et al. 1974). Ces glandes épidermiques semblent se diviser en deux grandes catégories : pédonculées et sessiles. Les glandes pédonculées (Fig. 1) peuvent être constituées d'une seule cellule ou un petit groupe de cellules disposées en rosette sur un socle unique ou pluricellulaire. L’absence d'étude ontogénétique approfondie a conduit à l'hypothèse qu'une partie de cette variation peut être attribuable à l'observation des différents stades de développement (Ledbetter et Krikorian 1975). Les glandes sessiles ne possèdent pas de tige et ont des cellules sécrétrices se trouvant sur ou sous la surface de l'épiderme (Fairbairn, 1972). Dans les deux cas, les cellules glandulaires sont recouvertes d'une « gaine » sous laquelle les résines sont sécrétées par l'intermédiaire de vésicules (Mahlberg et Kim, 1992). Cette gaine se compose d'une cuticule qui recouvre une couche de polysaccharides (présumés être de la cellulose) provenant de la paroi primaire (Hammond et Mahlberg 1978). Les résines s’accumulent jusqu'à ce que la gaine se renfle loin des cellules sécrétrices, formant une structure sphéroïde. La résine est ensuite libérée par la rupture de la membrane ou à travers les pores de sa surface (De Pasquale 1974). La teneur en cannabinoïdes de chaque partie de la plante varie, parallèlement à la répartition des glandes (Fetterman et al. 1971, Honma et al. 1971a et 1971b, Kimura et Okamoto 1970, Ohlsson et al. 1971, Ono et al. 1972), bien que Turner et al . (1978) ne soient pas d’accord. Les racines ne contiennent que des traces. Tiges, branches et brindilles contiennent de plus grandes quantités, mais pas autant que sur les feuilles. Les feuilles végétatives contiennent des quantités variables en fonction de leurs positions sur la plante : les feuilles inférieures en possèdent moins et les supérieures plus. Les glandes des feuilles sont les plus denses sur la surface inférieure. La plus grande quantité de cannabinoïdes se trouve près de chaque extrémité apicale (Kimura et Okamoto 1970, Steinberg et al. 1975), bien que Ono et al. (1972) semblent différer sur ce point. Cette variation dans le placement des glandes peut être due ou bien à une perte de glandes lors de la maturation de la feuille, ou bien d’une plus grande dotation de glandes sur les feuilles produites lors de la maturation de la plante. Des études complémentaires sur ce point sont nécessaires.
Une fois que la différenciation sexuelle a eu lieu, la génération des organes reproducteurs féminins et de leurs bractées associées augmente la teneur totale en cannabinoïdes de la plante. Les bractées sous-tendant les fleurs femelles contiennent une plus grande densité de glandes que les feuilles. Le petit bractéole en forme de coupe (bractée périphérique) renfermant le pistil a la plus haute teneur en cannabinoïdes de toute la plante (Kimura et Okamoto 1970, Honma et al. 1971a et 1971b). En second vient la fleur elle-même (Fetterman et al. 1971b). Comme ce site n'a pas de structure épidermique glandulaire, les cannabinoïdes présents doivent provenir soit de sites de production encore non découverts, soit par simple adhérence de la résine de la surface intérieure du bractéole proche. Cette conjecture est appuyée par la constatation que les akènes ne contiennent pas de quantités substantielles de cannabinoïdes (Fetterman et al. 1971b, Ono et al. 1972). Les structures de reproduction de la plante mâle ont également une plus grande concentration de cannabinoïdes (Fetterman et al. 1971b, Ohlsson et al. 1971). Les glandes pédonculées ont été observées couvrant le tépale, avec des glandes fortement pédonculées sur le filament étamine (Dayanadan et Kaufman, 1976). En outre, des rangées de très grandes glandes sessiles se trouvent situées dans les rainures de l’anthère elle-même (Dayanadan et Kaufman 1976, Fairbairn, 1972) et fournissent apparemment un pollen d'une teneur en cannabinoïdes considérable (Paris et al. 1975a).
Delta-9-tétrahydrocannabinol (THC) est le cannabinoïde responsable des principaux effets psychoactifs de la plupart des préparations cannabiques (Mechoulam 1970). Dans certaines variétés de cannabis, d'autres cannabinoïdes homologues semblent avoir remplacé le groupe pentyle habituel lié à l'anneau aromatique par un propyle (De Zeeuw et al. 1972b & 1973a, Fetterman et Turner 1972, Gill 1971, Gill et al. 1970, Merkus 1971, Vree et al. 1972a, Turner et al. 1973a) ou occasionnellement par un groupe méthyle (Vree et al. 1971 et 1972b). D'autres propositions ont été faites pour une substitution par le butyle (Harvey, 1976) ou l’heptyle (Isbell 1973), mais ces derniers semblent particulièrement peu crédibles. Le THC est supposé être produit par la plante (Fig. 2) à partir du cannabidiol (CBD) qui, à son tour, est dérivé du cannabigerol (CBG) généré par des précurseurs non-cannabinoïdes (Hammond et Mahlberg 1994, Shoyama et al. 1984, Turner et Mahlberg 1988). Le CBG est aussi le précurseur biogénétique du cannabichromene (CBC). Certains des cannabinoïdes (par exemple, cannabielsoin, cannabinol, et cannabicyclol) sont probablement les produits de dégradation des cannabinoïdes produits par voie enzymatique (par exemple, le CBD, le THC et le CBC, respectivement).
Fig 2 :
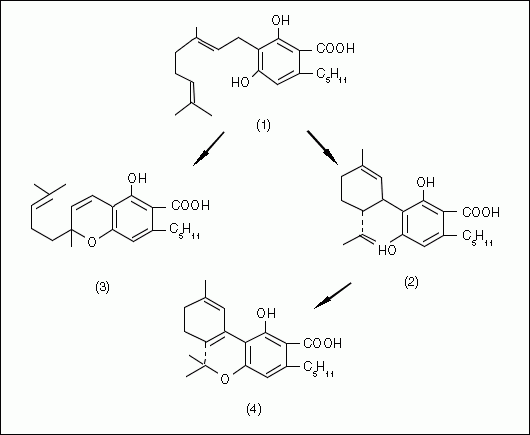
Biosynthèse des acides cannabinoïdes (redessinées d’après Shoyama et al. 1975): 1 = cannabigerol (CBG), 2 = cannabidiol (CBD); 3 = cannabichromene (CBC), 4 = delta-9-tétrahydrocannabinol (THC).
Les cannabinoïdes et le stress environnemental
Dessèchement
Le THC est une huile visqueuse hydrophobe (Garrett et Hunt 1974) qui résiste à la cristallisation (Gaoni et Mechoulam 1971) et est de faible volatilité (Adams et al. 1941). Comme les résines collantes produites et dégagées sur la surface de la plante sont des combinaisons variables de THC, d'autres cannabinoïdes et de terpènes, elles peuvent être considérées comme analogues aux revêtements cireux des cactus et autres plantes succulentes qui servent de barrière à la perte d’eau dans des environnements secs.
Bouquet (1950) a mentionné que les zones de culture de Cannabis de la partie occidentale et montagneuse du Liban sont moins favorables pour la production de résine en raison des vents marins humides. De Faubert Maunder (1976) a également observé que la résine nécessaire à la production du haschich n’est produite que «dans une ceinture passant de l'est du Maroc, suivant la région méditerranéenne, l'Arabie et le sous-continent indien et se terminant dans l'Indochine". Ce sont surtout des zones remarquables pour leurs précipitations éparses, une faible humidité et un climat ensoleillé. Est-ce simplement une coïncidence que la résine y soit produite ?
Les preuves expérimentales qui renforcent cette corrélation s'accumulent. Sharma (1975) a rapporté une plus grande densité de trichomes glandulaires sur les feuilles de cannabis dans des circonstances de culture xériques. Paris et al. (1975a) ont démontré une nette augmentation de la teneur en cannabinoïdes du pollen de cannabis lorsque l’humidité diminue. Murari et al. (1983) ont mis en place des cultures de cannabis dans trois zones climatiques de l'Italie et a relevé des niveaux de THC plus importants dans les plantes cultivées dans le climat dit "continental" (par opposition à «maritime»), le plus sec. Hakim al. (1986) rapportent que les souches de cannabis anglais riche en CBD et pauvre en THC produisent des quantités importantes de THC et peu de CBD lorsqu'elles sont cultivées au Soudan. Cette tendance a été accentuée chez la génération suivante de plantes.
Haney et Kutscheid (1973) ont montré des corrélations significatives entre la teneur en cannabinoïdes de la plante et les facteurs influant sur l'humidité du sol : teneur en argile ou en sable, pente du terrain, concurrence de la végétation environnante. Dans certains cas, ce dernier facteur a induit une plante rabougrie avec des «racines disproportionnellement petites », qui auraient tendance à augmenter à la fois la fréquence et la gravité du stress de dessèchement.
Dans une étude concernant 10 emplacements au Kansas, Latta et Eaton (1975) ont constaté de grandes différences dans la teneur en cannabinoïdes de la plante, en observant que « delta-9-THC était compris entre 0,012 à 0,49% et augmentait généralement à des endroits devenus moins favorables à la croissance des plantes, ce qui suggère qu’un stress augmenté de la plante renforce la production de delta-9-THC». Il a également été fait mention d'une corrélation positive entre la végétation concurrente et la teneur en THC. Bien que la zone d'échantillonnage n’ait pas été considérée comme très faible en humidité, ils ont émis l'hypothèse qu’ « une plus grande différence entre les lieux aurait pu être observée dans des conditions de sécheresse ».
Température
La température peut jouer un rôle dans la teneur en cannabinoïdes, mais peut-être seulement par association avec l'humidité disponible. Boucher et al. (1974) ont signalé une augmentation de la teneur en cannabinoïdes avec la température (32o C. vs 22o C.). Cependant, certaines variables (telles que l’augmentation de la perte d'eau en raison de l'évaporation accélérée et de la transpiration des plantes à des températures élevées) ont été laissées de coté. En revanche, Bazzaz et al. (1975), utilisant 4 écotypes de cannabis de caractères tropicaux et tempérés, ont démontré une diminution de la production de cannabinoïdes avec l’augmentation de la température (32o C. vs 23o C). D'autres études de Braut-Boucher (1980) sur des clones de 2 souches d'Afrique du Sud ont révélé un modèle plus complexe de la biosynthèse selon la souche, le sexe et les homologues chimiques produits. De toute évidence, une étude plus approfondie de ce paramètre est nécessaire.
Éléments nutritifs du sol
L’équilibre minéral semble influencer la production des cannabinoïdes. Krejci (1970) a constaté des augmentations liées a de « mauvaises conditions du sol» non spécifiées. Haney et Kutcheid (1973) ont montré l'influence des concentrations de K, P, Ca et N sur du Cannabis de l’Illinois. Ils rapportent une corrélation négative entre le K du sol et la teneur de la plante en delta 9-THC, bien que les interactions K-P, N et Ca ont été corrélées positivement avec elle. Ces minéraux affectent également la production de CBD, de delta-8-THC et de cannabinol (CBN), bien que ces deux derniers composés soient maintenant considérés comme étant des produits de dégradation spontanée du delta-9-THC. Balland et al. (1973) ont démontré l'importance d'un niveau optimal de Fe pour la synthèse végétale de THC. Latta et Eaton (1975) ont rapporté l’importance de Mg et Fe pour la production de THC, ce qui suggère que ces minéraux peuvent servir en tant que co-facteurs enzymatiques. Coffman et Gentner (1975) ont également confirmé l'importance du type de sol et de la teneur en minéraux et ont observé une corrélation négative significative entre la hauteur de la plante à la récolte et la teneur en THC. Fait intéressant, Marshman et al. (1976) rapportent de plus grandes teneurs en THC dans les plantes jamaïcaines poussant dans des sols «organiquement» enrichis (vs engraissés artificiellement).
Insectes prédateurs
Blesser la plante a été utilisé comme une méthode pour augmenter la production de résine (Emboden 1972). Cette augmentation peut être une réaction au dessèchement au-dessus du point d'interruption vasculaire. Dans des circonstances naturelles, une blessure survient le plus souvent à la suite d'attaques d'insectes. Il s'agit d'une source de stress de l'environnement où la production de terpènes et des cannabinoïdes pourrait diminuer. Le cannabis est soumis à peu de prédateurs (Smith et Haney 1973, Stannard et al. 1970) et a même été utilisé en extrait ou sous forme de poudre comme insecticide (Bouquet 1950) ou répulsif (Khare et al. 1974). Ses mécanismes apparents de défense comprennent une généreuse répartition de larges trichomes non glandulaires, l'émission de substances terpénoïdes volatiles, et de l'exsudation de collants cannabinoïdes. Le cannabis est souvent remarqué pour ses qualités aromatiques et bon nombre des terpènes produits sont connus pour posséder des propriétés répulsives vis-à-vis des insectes. Parmi ceux-ci, l'alpha et beta pinène, limonène, terpinéol et bornéol. Les pinènes et le limonène représentent plus de 75% des substances volatiles détectées dans l'atmosphère environnante, mais ne représentent que 7% de l'huile essentielle (Hood et al. 1973). Conformément à la densité de trichomes glandulaires et le contenu de cannabinoïdes, la majorité de ces terpènes est produite plus par les inflorescences que par les feuilles, et leur teneur est également plus importante dans la plante femelle (Martin et al. 1961).
Aucune étude de toxicité sur les insectes utilisant des cannabinoïdes isolés n’a été publiée à ce jour. Rothschild et al. (1977) ont montré que le cannabis mexicain riche en THC (par opposition au cannabis turc riche en CBD) est fatal à la larve de l’Ecaille Martre (Arctia caja), mais pas à la nymphe de sauterelle du Nigeria (Zonocerus elegans). Rothschild et Fairbairn (1980) plus tard ont révélé que le THC pur (vs CBD) pulvérisé sur les feuilles du chou, repousse le grand papillon blanc du chou (Pieris brassicae).
Les cannabinoïdes peuvent également servir de défense purement mécanique. Une minuscule créature traversant la surface de la feuille pourrait entraîner une rupture des réservoirs globulaires de résine des trichomes glandulaires (Ledbetter et Krikorian 1975) et s’engluer dans la résine. Un insecte mâcheur de bonne taille, capable de surmonter ces défenses, aurait encore de la difficulté à mastiquer la résine collante, avec les trichomes cystolithiques et les trichomes silicifiés présents sur la feuille. L'utilité de ces caractéristiques épidermiques comme anti-appétents est également un corollaire de leur présence prépondérante sur la surface de la feuille abaxial favorisée par l'insecte. Bien que les stratégies ci-dessus constituent un système en apparence complexe, beaucoup d'autres plantes (Levin 1973) et même des arthropodes (Eisner 1970) utilisent les mécanismes de défense similaire, en employant souvent des terpènes identiques!
Concurrence
Les terpènes peuvent également contribuer à supprimer la croissance de la végétation environnante (Muller et Hauge 1967, Muller et al. 1964). Haney et Bazzaz (1970) ont spéculé qu'un tel mécanisme peut être effectif chez le Cannabis. Ils ont en outre montré que, comme la production de terpènes n'est pas pleinement développée chez les très jeunes plants, cela peut expliquer leur incapacité à rivaliser avec succès avec d'autres végétaux jusqu'à être plus mature. L'observation (Latta et Eaton, 1975) d'une production accrue de THC par les plantes en concurrence avec la végétation environnante, « à une période de la saison de croissance où l'humidité n'était pas limitante», peut indiquer une stimulation de la production de cannabinoïdes différente de la simple pénurie d'eau.
Les bactéries et les champignons
Les cannabinoïdes peuvent servir de protecteur contre les microorganismes. Des préparations de cannabis ont longtemps servi de médicaments (en dehors de leurs propriétés psychoactives) et sont efficaces contre une grande variété de maladies infectieuses (Kabelic et al. 1960, Mikuriya 1969). Ces propriétés antibiotiques ont été démontrées à la fois avec des extraits de cannabis (Ferenczy et al. 1958, Kabelic et al. 1960, Radosevic et al. 1962) et différents cannabinoïdes isolés (ElSohly et al. 1982, Farkas et Andrassy 1976, Gal et Vajda 1970, Van Klingeren et Ten Ham 1976). Le CBG a été comparé (Mechoulam et Gaoni 1965) pour sa « structure et ses propriétés antibactériennes au grifolin, un antibiotique du basidiomycète Grifolia Conflens ». Ferency (1956) a démontré les propriétés antibiotiques des semences de cannabis, un facteur qui peut aider à sa survie lors de l'hivernage. La résine adhérente à la surface de la graine, ainsi qu’un paillis de feuilles de cannabis fanées autour, peuvent servir à cet égard.
Quelques-uns des nombreux agents pathogènes fongiques qui affectent notamment le cannabis comprennent Alternaria Alterata (Haney et Kutsheid 1975), Ascochyta prasadii (Shukla et Pathak 1967), Botryosphaeria marconii (Charles et Jenkins 1914), Cercospora cannabina et le C. cannabis (Lentz et al. 1974) , Fusarium oxysporum (McCain et Noviello 1985), Phoma sp. (Srivastava et Naithani 1979) et Phomopsis ganjae (McPartland 1984).
A. alterata attaque le cannabis de l’Illinois et détruit 2.8-45.5% des semences (Haney et Kutsheid 1975), le résultat chez ces espèces sont des taches foliaires. McPartland (1984) a démontré les effets inhibiteurs de THC et CBD sur Phomopsis ganjae. Toutefois, De Meijer et al. (1992), en évaluant une grande collection de génotypes de cannabis, n'a pas trouvé une corrélation entre la teneur en cannabinoïdes et l'apparition de Botrytis. L’évolution chez les champignons d'un mécanisme pour surmonter les défenses de la plante cannabinoïde peut être responsable de leurs succès comme agents pathogènes. En effet, certains sont capables de métaboliser le THC et d’autres cannabinoïdes (Binder 1976, Binder et Popp 1980, Robertson et al. 1975).
Le rayonnement ultraviolet
Un autre stress auquel les plantes sont soumises provient de leur exposition quotidienne au soleil. Bien que nécessaire pour maintenir la photosynthèse, la lumière naturelle contient des rayonnements ultraviolets biologiquement destructeurs. Cette pression sélective a apparemment affecté l'évolution de certaines défenses, parmi eux, un criblage chimique fonctionnellement analogue à la pigmentation de la peau humaine. Une enquête préliminaire (Pate 1983) a indiqué que, dans les zones de forte exposition rayonnement ultraviolet, les propriétés d'absorption des rayons UV-B (280-315 nm) par le THC peut avoir conféré un avantage évolutif pour le Cannabis, capable d'une plus grande production de ce composé à partir des précurseurs biogénétique CBD. La mesure dans laquelle cette production est influencée par un stress induit d’UV-B environnemental a été déterminée expérimentalement par Lydon et al. (1987). Leurs expériences montrent que dans des conditions d'exposition forte aux UV-B, le cannabis produit des quantités significativement plus élevées de THC. Ils ont également démontré l'instabilité chimique du CBD lors de l'exposition aux UV-B (Lydon et Teramura 1987), contrairement à la stabilité du THC et du CBC. Toutefois, les études de Brenneisen (1984) n’ont montré qu'une différence mineure en absorption UV-B entre le THC et le CBD, tandis que les propriétés d'absorption du CBC se révélèrent beaucoup plus grandes. Peut-être la relation entre les cannabinoïdes et UV-B n'est pas aussi simple que supposée de prime abord. Deux autres explications doivent désormais être prises en considération. Même si le CBD absorbe autant que le THC, dans des domaines de rayonnement UV-B ambiant élevé, le CBD peut être plus rapidement dégradé. Cela pourrait entraîner une baisse de la disponibilité du CBD présent ou faire de ce composé le moins énergiquement efficace a produire pour la plante. De plus, la plus grande capacité d'absorption UV-B du CBC par rapport au THC et la stabilité relative du CBC par rapport au CBD pourrait désigner cette substance comme un écran de protection. La présence de grandes quantités de THC devrait alors être expliquée comme un simple stock accumulé à la fin des réactions enzymatiques de formation de cannabinoïdes. Toutefois, des travaux supplémentaires sont nécessaires pour résoudre le fait que les expériences de Lydon (1985) ne montrent pas une augmentation de la production de CBC proportionnelle à l'augmentation à l’exposition aux UV-B.
Cette hypothèse de pigmentation au CBC impliquerait l'élaboration d'une alternative à la voie biochimique acceptée du CBG au THC par l'intermédiaire du CBD. Jusqu'en 1973 (Turner et Hadley, 1973), la séparation du CBD et du CBC par chromatographie en phase gazeuse a été difficile à accomplir, et les nombreux pics identifiés comme du CBD dans la littérature précédente aurait pu être du CBC. En effet, il a été noté (de Faubert Maunder 1970) et corroboré par GC / MS (Turner et Hadley, 1973) que certaines souches tropicales de cannabis ne contiennent pas de CBD du tout, mais ont du THC en abondance. Ce phénomène n'a pas été observé pour les variétés de Cannabis tempérées du nord. L’absence de CBD a conduit certains auteurs (de Faubert Maunder 1970, Turner et Hadley 1973) à spéculer qu'une autre voie biogénétique menant au THC est impliquée. Des faits épars à travers la littérature indiquent effectivement une alternative possible. Holley et al. (1975) ont montré que les plantes cultivées du Mississippi ont une teneur considérable de CBC, souvent plus que de CBD. Dans certains exemples, ou le CBD ou le CBC était absent, mais en aucun cas il n’y avait de plantes dépourvues des deux. L’analyse de cultures au Mexique et au Costa Rica a servi à accentuer cette tendance. Un seul exemple cultivé dans ces pays respectifs a révélé l’absence de CBD bien que des quantités appréciables de CBC aient été trouvées. L'inverse semble également vrai. Des semences du Mexique dépourvues de CBD ont été plantées dans le Mississippi et ont produit des plantes contenant du CBD.
Le CBC pourrait-il être impliqué dans des réactions biogénétiques alternatives menant au THC? Yagen et Mechoulam (1969) ont synthétisé du THC (quoique avec un faible rendement) directement à partir du CBC. La méthode utilisée est similaire à la cyclisation de CBD en THC par catalyse acide (Gaoni et Mechoulam 1966). Les sous-produits de réaction comprennent : cannabicyclol, delta-8-THC et Delta-4 ,8-iso-THC, produits qui ont été trouvés dans des analyses de cannabis (par exemple, Novotny et al. 1976). Enfin, les études de suivi des radio-isotopes (Shoyama et al. 1975) ont découvert le fait intrigant que le CBG radiomarqué alimentant une souche de cannabis très faible productrice de THC se retrouve dans le CBD, mais alimentant une souche de cannabis forte productrice de THC elle n’apparait seulement que comme CBC et THC. Du CBD marqué alimentant une plante mexicaine fortement productrice de THC est apparu en tant que THC. Malheureusement, les plantes n’ont pas été nourries de CBC radiomarqué, selon la conviction que le CBC n’intervient dans les réactions chimiques que jusqu’au CBD et pas ensuite. Leurs recherches ont indiqué que l’incorporation du CBG marqué dans le CBD ou le CBC dépendait de l’âge. Vogelman et al. (1988) signalent également que le stade de développement des jeunes plants, ainsi que leur exposition à la lumière, affecte l'apparition du CBG, du CBC ou du THC dans le cannabis mexicain. Aucune trace de CBD n’a été signalée.
Conclusions
Bien que la chimie du cannabis ait été soumise à des études intensives, d'autres travaux sont nécessaires pour montrer la relation de sa résine aux facteurs biotiques et abiotiques de l'environnement. Les trichomes glandulaires sont les sites de production de l'essentiel des composés secondaires présents. Il est probable que les cannabinoïdes et les terpènes associés servent d'agents de défense dans différents rôles : anti-dessèchement, antimicrobien, anti-appétences et pigmentation par UV-B. La sélection par les attaques UV-B semble être responsable de la distribution de variétés de cannabis riches en THC dans les zones de rayonnement ambiant élevé, et peut avoir influé sur l'évolution d'une voie biogénétique alternative du CBG au THC dans certaines de ces souches. Bien que les stress environnementaux semblent être un encouragement direct à une production chimique renforcée pour les plantes individuelles, il faut remarquer que de telles contraintes peuvent également biaiser les données en hâtant le développement de structures florales très glandulaires. Les études à venir nécessiteront un échantillonnage soigneux et représentatif pour assurer des résultats significatifs.
Quelques définitions :
Terpène : Les terpènes sont une classe d'hydrocarbures, produits par de nombreuses plantes, en particulier les conifères. Ce sont des composants majeurs de la résine et de l'essence de térébenthine produite à partir de résine.
Labilité : En chimie et en biochimie, la labilité est la capacité d'un nucléofuge (ou groupe partant) à pouvoir se détacher plus ou moins facilement d'une molécule. Plus un groupe se détache facilement, plus il est dit labile. Dans le cas particulier où le groupe partant est l'ion H+ (appelé « proton » puisqu'un atome d'hydrogène qui perd son unique électron n'est plus que réduit à son noyau, c'est à dire un proton), la labilité de ce proton donnera le caractère protique ou aprotique à la molécule qui le libère ou non.
Akène : En botanique, un akène (parfois écrit achaine ou achène) est un fruit sec, indéhiscent, à graine unique dont le péricarpe, plus ou moins sclérifié, n'est pas soudé à la graine (à la différence du caryopse).
Le terme est formé sur la racine grecque kainein, ouvrir, avec le préfixe privatif a, en référence au caractère indéhiscent de ce fruit.
L'akène résulte de la transformation d'un carpelle unique ou multiple (polyakènes).
Xérique : Milieu caractérisé par une aridité persistante.
Références
* Abel E., 1980. Marihuana: The first 12,000 years. Plenum Press, New York.
* Adams R. and C.K. Caine, W.D. McPhee and T.N. Wearn, 1941. Structure of cannabidiol. XII. Isomerization to tetrahydro-cannabinols. Journal of the American Chemical Society 63: 2209-2213.
* Adams Jr., T.C. and L.A. Jones, 1973. Long chain hydrocarbons of Cannabis and its smoke. Agr. Food Chemistry 21: 1129-1131.
* Bazzaz F.A., D. Dusek, D.S. Seigler and A.W. Haney, 1975. Photosynthesis and cannabinoid content of temperate and tropical populations of Cannabis sativa. Biochemical Systematics and Ecology 3: 15-18.
* Binder M., 1976. Microbial transformation of (-)-delta-3,4-trans-tetrahydrocannabinol by Cunninghamella blakesleena Lender. Helvetica Chimica Acta 63: 1674-1684.
* Binder M. and A. Popp, 1980. Microbial transformation on cannabinoids. Part 3: major metabolites of (3R, 4R)-delta-1-tetrahydrocannabinol. Helvetica Chimica Acta 2515-2518.
* Boucher F., L. Cosson, J. Unger and M.R. Paris, 1974. Le Cannabis sativa L.; races chemiques ou varietes. Pl. Med. Phytotherap. 8: 20-31.
* Bouquet J., 1950. Cannabis. UN Bulletin on Narcotics 2: 14-30.
* Braut-Boucher F., 1980. Effet des conditions ecophysiologiques sur la croissance, le developpement et le contenu en cannabinoides de clones correspondant aux deux types chimiques du Cannabis sativa L. originaire d'Afrique du Sud. Physiol. Veg. 18: 207-221.
* Brenneisen R., 1984. Psychotrope Drogen II. Bestimmung der Cannabinoid in Cannabis sativa L. und in Cannabisprodukten mittels Hochdruckflussigkeitschromatographie (HPLC). Pharm. Acta Helv. 59: 247-259.
* Briosi G. and F. Tognini, 1894. Anatomia della canapa. Parte prima: Organi sessuali. Atti. Ist. Bot. Pavia Ser. II. 3: 91-209.
* Charles,V. and A. Jenkins, 1914. A fungous disease of hemp. J. Agric. Res. 3: 81-85.
* Coffman C.B. and W.A. Gentner, 1975. Cannabinoid profile and elemental uptake of Cannabis sativa L. as influenced by soil characteristics. Agronomy Journal 67: 491-497.
* Dayanandan P. and P.B. Kaufman, 1976. Trichomes of Cannabis sativa L. (Cannabaceae). American Journal of Botany 63: 578-591
* De Faubert Maunder M.J., 1970. A comparative evaluation of the tetrahydrocannabinol content of Cannabis plants. J. Ass. Pub. Anal. 8: 42-47.
* De Faubert Maunder M.J., 1976. The forensic significance of the age and origin of Cannabis. Med. Sci. Law 16: 78-89.
* De Meijer E.P.M., H.J. Van der Kamp and F.A. Van Eeuwijk. Characterization of Cannabis accessions with regard to cannabinoid content in relation to other plant characters. Euphytica 62: 187-200.
* De Pasquale A., G. Tumino and R.C. De Pasquale, 1974. Micromorphology of the epidermic surfaces of female plants of Cannabis sativa L. UN Bulletin on Narcotics 26: 27-40
* De Zeeuw R.A., Th. M. Malingre and F.W.H.M. Merkus, 1972a. Tetrahydrocannabinolic acid, an important component in the evaluation of Cannabis products. J. Pharm. Pharmacology 24: 1-6.
* De Zeeuw R.A., T.B. Vree, D.D. Breimer and C.A.M. Van Ginnekin, 1973a. Cannabivarichromene, a new cannabinoid with a propyl side chain in Cannabis. Experientia 29: 260-261.
* De Zeeuw R.A., J. Wijsbek, D.D. Breimer, T.B. Vree, C.A. Van Ginneken and J.M. van Rossum, 1972b. Cannabinoids with a propyl side chain in Cannabis. Occurence and chromatographic behavior. Science 175: 778-779.
* De Zeeuw R.A., J. Wijsbek and Th.M. Malingre, 1973b. Interference of alkanes in the gas chromatographic analysis of Cannabis products. J. Pharm. Pharmacology 25: 21-26.
* Eisner T., 1970. Chemical defense against predation in arthropods. Page 127 in E. Sondheimer and J.B. Simone, eds., Chemical ecology, Academic Press, New York.
* ElSohly M.A. and C.E. Turner, 1976. A review of nitrogen containing compounds from Cannabis sativa L. Pharmaceutisch Weekblad III: 1069-1075.
* ElSohly H., C.E. Turner, A.M. Clark and M.A. ElSohly, 1982. Synthesis and antimicrobial properties of certain cannabichrome and cannabigerol related compounds. Journal of the Pharmaceutical Sciences 71: 1319-1323.
* Emboden W.A., 1972. Ritual use of Cannabis sativa L.: a historical-ethnographic survey. Page 224 in P. Furst, ed., Flesh of the gods, Praeger Press, New York.
* Fairbairn J.W., 1972. The trichomes and glands of Cannabis sativa L. UN Bulletin on Narcotics 24: 29-33.
* Farkas J., and E. Andrassy, 1976. The sporostatic effect of cannabidiolic acid. Acta Alimentaria 5: 57-67.
* Ferenczy L., 1956. Antibacterial substances in seeds of Cannabis. Nature 178: 639.
* Ferenczy L., L. Grazca and I. Jakobey, 1958. An antibacterial preparation from hemp (Cannabis sativa L.). Naturwissenschaften 45: 188.
* Fetterman P.S., N.J. Doorenbos, E.S. Keith and M.W. Quimby, 1971a. A simple gas liquid chromatography procedure for determination of cannabinoidic acids in Cannabis sativa L. Experientia 27: 988-90.
* Fetterman P.S., E.S. Keith, C.W. Waller, O. Guerrero, N.J. Doorenbos and M.W. Quimby, 1971b. Mississippi-grown Cannabis sativa L.: Preliminary observation on chemical definition of phenotype and variations in tetrahydrocannabinol content versus age, sex, and plant part. Journal of the Pharmaceutical Sciences 60: 1246-1249.
* Fetterman P.S. and C.E. Turner, 1972. Constituents of Cannabis sativa L. I. Propyl homologs of cannabinoids from an Indian variant. Journal of the Pharmaceutical Sciences 61: 1476-1477.
* Gal I.E. and O. Vajda, 1970. Influence of cannabidiolic acid on microorganisms. Elelmez. Ipar. 23: 336-339.
* Gaoni Y. and R. Mechoulam, 1966. Hashish, VII. The isomerization of cannabidiol to tetrahydrocannabinols. Tetrahedron 22: 1481-1488.
* Gaoni Y. and R. Mechoulam, 1971. The isolation and structure of delta-1-tetrahydrocannabinol and other neutral cannabinoids from hashish. Journal of the American Chemical Society 93: 217-224.
* Garrett E.R. and C.A. Hunt, 1974. Physico-chemical properties, solubility and protein binding of delta-9-tetrahydrocannabinol. Journal of the Pharmaceutical Sciences 63: 1056-1064.
* Gellert M., I. Novak, M. Szell and K. Szendrei, 1974. Glycosidic components of Cannabis sativa L. I. Flavonoids. UN Document ST/SOA/SER.S/50 Sept. 20.
* Gill E.W., 1971. Propyl homologue of tetrahydrohcannabinol: Its isolation from Cannabis, properties and synthesis. Journal of the Chemical Society p. 579-82.
* Gill E.W., W.D.M. Paton and R.G. Pertwee, 1970. Preliminary experiments on the chemistry and pharmacology of Cannabis. Nature 228: 134-136.
* Grlic L. and A. Andrec, 1961. The content of acid fraction in Cannabis resin of various age and provenance. Experientia 17: 325-326.
* Hakim H.A., Y.A. El Kheir and M.I. Mohamed, 1986. Effect of climate on the content of a CBD-rich variant of Cannabis. Fitoterapia 57: 239-241.
* Hammond C.T. and P.G. Mahlberg, 1973. Morphology of glandular hairs of Cannabis sativa from scanning electron microscopy. American Journal of Botany 60: 524-528.
* Hammond C.T. and P.G. Mahlberg, 1978. Ultrastructural development of capitate glandular hairs of Cannabis sativa L. (Cannabaceae). American Journal of Botany 65: 140-151.
* Hammond C.T. and P.G. Mahlberg, 1994. Phloroglucinol glucoside as a natural constituent of Cannabis sativa. Phytochemistry 37: 755-756.
* Haney A. and F.A. Bazzaz, 1970. Discussion in The botany and chemistry of Cannabis. Joyce, C.R.B. and S.H. Curry, eds. Churchill, London.
* Haney A. and B.B. Kutscheid, 1973. Quantitative variation in chemical constituents of marihuana from stands of naturalized Cannabis sativa L. in east central Illinois. Economic Botany 27: 193-203.
* Haney A. and B.B. Kutscheid, 1975. An ecological study of naturalized hemp (Cannabis sativa L.) in east-central Illinois. American Midland Naturalist 93: 1-24.
* Hanus I., 1975a. The present state of knowledge in the chemistry of substances of Cannabis sativa L. III. Terpenoid substances. Acta Universitatis Palackianae Olomucensis Facultatis Medicae 73: 233-239.
* Hanus I., 1975b. The present state of knowledge in the chemistry of substances of Cannabis sativa L. IV. Nitrogen containing compounds. Acta Universitatis Palackianae Olomucensis Facultatis Medicae 73: 241-244.
* Hanus I., 1976a. The present state of knowledge in the chemistry of substances of Cannabis sativa L. V. Addendum to part I-IV. Acta Universitatis Palackianae Olomucensis Facultatis Medicae 76: 153-166.
* Hanus I., 1976b. The present state of knowledge in the chemistry of substances of Cannabis sativa L. VI. The other contained substances. Acta Universitatis Palackianae Olomucensis Facultatis Medicae 76: 167-173.
* Harvey O.J., 1976. Characterization of the butyl homologs of delta-1-tetrahydrocannabinol and cannabidiol in samples of Cannabis by combined gas chromatography and mass spectrometry. J. Pharm. Pharmacol. 28: 280-285.
* Hendricks H., T.M. Malingre, S. Batterman and R. Bos, 1975. Mono- and sesquiterpene hydrocarbons of the essential oil of Cannabis sativa. Phytochemistry 14: 814-15.
* Holley J. H., K.W. Hadley and C.E. Turner, 1975. Constituents of Cannabis sativa L. XI. Cannabidiol and cannabichromene in samples of known geographical origin. Journal of the Pharmaceutical Sciences 64: 892-895.
* Honma S., H. Kaneshima, M. Mori,and T. Kitsutaka, 1971a. Cannabis grown in Hokkaido. 2. Contents of cannabinol, tetrahydrocannabinol and cannabidiol in wild Cannabis. Hokkaidoritsu Eisei Kenkyushoho 21: 180-185.
* Honma S., H. Kaneshima, M. Mori and T. Kitsutaka, 1971b. Cannabis grown in Hokkaido. 3. Variation in the amount of narcotic components of Cannabis and its growth. Hokkaidoritsu Eisei Kenkyushoho 21: 186-190.
* Hood L.V.S., M.E. Dames and G.T. Barry, 1973. Headspace volatiles of marijuana. Nature 242: 402-403.
* Isbell H., 1973. Research on Cannabis (marijuana). UN Bulletin on Narcotics 25: 37-48.
* Kabelik J., Z. Krejci and F. Santavy, 1960. Cannabis as a medicament. UN Bulletin on Narcotics 12: 5-23.
* Kaneshima H., M. Mori and N. Mizuno, 1973. Studies on Cannabis in Hokkaido (Part 6). The dependence of Cannabis plants on iron nutrition. Hokkaidoritsu Eisei Kenkyusho 23: 3-5.
* Khare B.P., S.B. Gupta and S. Chandra, 1974. Biological efficacy of some plant materials against Sitophilus oryzae Linneaeous. Indian Journal of Agricultural Research 8: 243-248.
* Kimura M. and K. Okamoto, 1970. Distribution of tetrahydrocannabinolic acid in fresh wild Cannabis. Experientia 26: 819-20.
* Krejci Z., 1970. Changes with maturation in amounts of biologically interesting substances of Cannabis. Page 49 in The botany and chemistry of Cannabis. Joyce, C.R.B. and S.H. Curry, eds. Churchill, London.
* Lanyon V.S., J.C. Turner and P.G. Mahlberg, 1981. Quantitative analysis of cannabinoids in the secretory product from captitate-stalked glands of Cannabis sativa L. (Cannabaceae). Botanical Gazette 142: 316-319.
* Latta R.P. and B.J. Eaton, 1975. Seasonal fluctuations in cannabinoid content of Kansas marijuana. Economic Botany 29: 153-163.
* Ledbetter M.C. and A.D. Krikorian, 1975. Trichomes of Cannabis sativa as viewed with scanning electron microscope. Phytomorphology 25: 166-176.
* Lentz P.L., C.E. Turner, L.W. Robertson and W.A. Gentner, 1974. First North American record for Cercospora cannabina, with notes on the identification of C. cannabina and C. cannabis. Plant Disease Reporter 58: 165-168.
* Levin D.A., 1973. The role of trichomes in plant defense. Quarterly Review of Biology 48: 3-16.
* Lydon J., 1985. The effects of Ultraviolet-B radiation on the growth, physiology and cannabinoid production of Cannabis sativa L. Ph.D. Dissertation, University of Maryland.
* Lydon J. and A.H. Teramura, 1987. Photochemical decomposition of cannabidiol in its resin base. Phytochemistry 26: 1216-1217.
* Lydon J., A.H. Teramura and C.B. Coffman, 1987. UV-B radiation effects on photosynthesis, growth and cannabinoid production of two Cannabis sativa chemotypes. Photochemistry and Photobiology 46: 201-206.
* Mahlberg P.G. and E.-S. Kim, 1992. Secretory vesicle formation in glandular trichomes of Cannabis sativa (Cannabaceae). American Journal of Botany 79: 166-173.
* Malingre T.N., H. Hendricks, S. Batterman, R. Bos and J. Visser, 1975. The essential oil of Cannabis sativa.. Planta Medica 28: 56-61.
* Marshman J., C.D. Yawney and R.E. Popham, 1976. A note on the cannabinoid content of Jamaican ganja. UN Bulletin on Narcotics 28: 63-68.
* Martin L., D.M. Smith and C.G. Farmilo, 1961. Essential oil from fresh Cannabis sativa and its use in identification. Nature 191: 774-776.
* Masoud A.N. and N.J. Doorenbos, 1973. Mississippi grown Cannabis sativa L. III. Cannabinoid and cannabinoic acid content. Journal of the Pharmaceutical Sciences 62: 313-315.
* McCain A.H. and C. Noviello, 1985. Biological control of Cannabis sativa. Pages 635-642 in Proceedings of the sixth international symposium on biological control of weeds. Delfosse, E.S., ed. Agricultural Canada, Ottawa, Canada.
* McPartland J.M., 1984. Pathogenicity of Phomopsis ganjae on Cannabis sativa and the fungistatic effect of cannabinoids produced by the host. Mycopathologia 87: 149-154.
* Mechoulam R., 1970. Marijuana chemistry. Science 168: 1159-1166.
* Mechoulam R. and Y. Gaoni, 1965. Hashish IV. The isolation of cannabinolic, cannabidiolic and cannabigerolic acids. Tetrahedron 21: 1223-1229.
* Merkus F.W.H.M., 1971. Two new constituents of hashish. Nature 232: 579-580.
* Mikuriya T.H., 1969. Marijuana in medicine: past, present and future. California Medicine 110: 34-40.
* Mobarak Z., D. Bieniek and F. Korte, 1974a. Studies on non-cannabinoids of hashish. Isolation and identification of some hydrocarbons. Chemosphere 3: 5-8.
* Mobarak Z., D. Bieniek and F. Korte, 1974b. Studies on non-cannabinoids of hashish II. An approach to correlate the geographical origin of Cannabis with hydrocarbon content by chromatographic analysis. Chemosphere 3: 265-70.
* Muller W.H. and R. Hauge, 1967. Volatile growth inhibitors produced by Salvia leucophylla: effect on seedling anatomy. Bulletin of the Torrey Botanical Club 94: 182-190.
* Muller C.H., W.H. Muller and B.L. Haines 1964. Volatile growth inhibitors produced by aromatic shrubs. Science 143: 471-73.
* Murari G., S. Lombardi, A.M. Puccini and R. De Sanctis, 1983. Influence of environmental conditions on tetrahydrocannabinol (delta-9-THC) in different cultivars of Cannabis sativa L. Fitoterapia 54: 195-201.
* Novotny M., M.L. Lee, C.-E. Low and A. Raymond, 1976. Analysis of marijuana samples from different origins by high-resolution gas-liquid chromatography for forensic application. Analytical Chemistry 48: 24-29.
* Ohlsson A., C.I. Abou-Chaar, S. Agurell, I.M. Nilsson, K. Olofsson and F. Sandberg, 1971. Cannabinoid constituents of male and female Cannabis sativa. UN Bulletin on Narcotics 23: 29-32.
* Ono M., M. Shimamine and K. Takahashi, 1972. Studies on Cannabis. III. Distribution of tetrahydrocannabinol in the Cannabis plant. Eisei Shikenjo Hokoku 90: 1-4.
* Paris M., F. Boucher and L. Cosson, 1975a. The constituents of Cannabis sativa pollen. Economic Botany 29: 245-253.
* Paris R.R., E. Henri and M. Paris, 1975b. O c-flavonoidima Cannabis sativa L. Arh. Farmaciju 25: 319-28.
* Paris R.R. and M.R. Paris, 1973. Sur les flavonoides du chanvre (Cannabis sativa L.). Comptes Rendus Acad. Sci. Ser. D. 277: 2369-71.
* Pate D.W., 1983. Possible role of ultraviolet radiation in evolution of Cannabis chemotypes. Economic Botany 37: 396-405.
* Radosevic A., M. Kupinic and Lj. Grlic, 1962. Antibiotic activity of various types of Cannabis resin. Nature 195: 1007-1009.
* Robertson L.W., M.A. Lyle and S. Billets, 1975. Biotranformation of cannabinoids by Syncephalastrum racemosum.. Biomedical Mass Spectroscopy 2: 266-271.
* Rothschild M., M.G. Rowen and J.W. Fairbairn, 1977. Storage of cannabinoids by Arctia caja and Zonocerus elegans fed on chemically distinct strains of `Cannabis sativa. Nature 266: 650-651.
* Rothschild M. and J.W. Fairbairn, 1980. Ovipositing butterfly (Pieris brassicae L.) distinguishes between aqueous extracts of two strains of Cannabis sativa L. and THC and CBD. Nature 286: 56-59.
* Sharma G.K., 1975. Altitudinal variation in leaf epidermal patterns of Cannabis sativa. Bulletin of the Torrey Botanical Club 102: 199-200.
* Shoyama Y., H. Hirano and I. Nishioka, 1984. Biosynthesis of Propyl Cannabinoid Acid and Its Biosynthetic Relationship with Pentyl and Methyl Cannabinoid Acids. Phytochemistry 29: 1909-1912.
* Shoyama Y., M. Yagi, I. Nishioka, and T. Yamauchi, 1975. Biosynthesis of cannabinoid acids. Phytochemistry 14: 2189-2192.
* Shukla D.D. and V.N. Pathak, 1967. A new species of Ascochyta on Cannabis sativa L. Sydowia Annals of Mycology 21: 277-278.
* Small E. and H.D. Beckstead, 1973. Common cannabinoid phenotypes in 350 stocks of Cannabis. Lloydia 36: 144-165.
* Smith G.E. and A. Haney, 1973. Grapholitha tristrigana (Clemens) (Lepidoptera: Tortricidae) on naturalized hemp (Cannabis sativa L.) in east-central Illinois. Transactions of the Illinois State Academy of Sciences 66: 38-41.
* Srivastava S.L. and S.C. Naithani, 1979. Cannabis sativa Linn., a new host for Phoma sp. Current Science of India 48: 1040-1005.
* Stannard L.J., J.R. Dewitt and T.C. Vance, 1970. The marijuana thrips, Oxythrips cannabensis, a new record for Illinois and North America. Transactions of the Illinois Academy of Sciences 63: 152-156.
* Steinberg S., J. Offermeier, B.I. Field and F.W. Jansen Van Ryssen, 1975. Investigation of the influence of soil types, environmental conditions, age and morphological plant parts on the chemical composition of Cannabis sativa (Dagga) plants. South African Medical Journal 45: 279.
* Turner C.E., M.A. ElSohly and E.G. Boeren, 1980. Constituents of Cannabis sativa L. XVII. A review of the natural constituents. Journal of Natural Products 43: 169-234.
* Turner C.E. and K. Hadley, 1973. Constituents of Cannabis sativa L. II. Absence of cannabidiol in an African variant. Journal of the Pharmaceutical Sciences 62: 251-255.
* Turner C.E., K. Hadley and P.S. Fetterman, 1973a. Constituents of Cannabis sativa L. VI: Propyl homologs in samples of known geographic origin. Journal of the Pharmaceutical Sciences 62: 1739-1741.
* Turner C.E., K.W. Hadley, P.S. Fetterman, N.J. Doorenbos , M.W. Quimby and C. Waller, 1973b. Constituents of Cannabis sativa L. IV: Stability of cannabinoids in stored plant material. Journal of the Pharmaceutical Sciences 62: 1601-1605.
* Turner J.C., J.K. Hemphill and P.G. Mahlberg, 1978. Cannabinoid composition and gland distribution in clones of Cannabis sativa L. (Cannabaceae). UN Bulletin on Narcotics 30: 55-65.
* Turner J.C. and Mahlberg, P.G., 1988. In vivo incorporation of labeled precursors into cannabinoids in seedlings of Cannabis sativa L. (Cannabaceae). Pages 263-270 in Chesher, G., P. Consroe and R. Musty, eds. Marihuana. Australian Government Publications, Canberra.
* Van Klingeren B. and M. Ten Ham, 1976. Antibacterial activity of delta-9-tetrahydrocannabinol and cannabidiol. Antonie van Leeuwenhoek Journal of Microbiology and Serology 42: 9-12.
* Vogelmann A.F., J.C. Turner and P.G. Mahlberg, 1988. Cannabinoid composition in seedlings compared to adult plants of Cannabis sativa. Journal of Natural Products 51: 1075-1079.
* Vree T.B., D.D. Breimer, C.A.M. Van Gienneken and J.M. Rossum, 1971. Identification of methyl and homologs of CBD, THC and CBN in hashish by a new method of combined gas chromatography-mass spectrometry. Acta Pharm. Sue. 8: 683-84.
* Vree T.B., D.D. Breimer, C.A.M. Van Gienneken and J.M. Rossum, 1972a. Identification of cannabicyclol with a pentyl or propyl side-chain by means of combined gas chromatography-mass spectrometry. Journal of Chromatography 74: 124-127.
* Vree T.B., D.D. Breimer, C.A.M. Van Gienneken and J.M. Rossum, 1972b. Identification in hashish of tetrahydrocannabinol, cannabidiol and cannabinol analogs with methyl side-chain. J. Pharm. Pharmacol. 24: 7-12.
* Yagen B. and R. Mechoulam, 1969. Stereospecific cyclizations and isomerizations of cannabichromene and related cannabinoids. Tetrahedron Letters 60: 5356-5363.
v/c Dad-
-
 1
1